メディカル機器開発・製造に関連する気になるカタログにチェックを入れると、まとめてダウンロードいただけます。
トレーサビリティの監査とは?課題と対策・製品を解説
目的・課題で絞り込む
カテゴリで絞り込む
OEM/ODM |
ポンプ・モーション技術 |
加工技術・材料 |
機械部品 |
計測機・センサ |
針・パイプ |
電子部品 |
配管部品・チューブ |
表面処理・改質 |
その他メディカル機器開発・製造 |

品質管理・検査におけるトレーサビリティの監査とは?
各社の製品
絞り込み条件:
▼チェックした製品のカタログをダウンロード
一度にダウンロードできるカタログは20件までです。
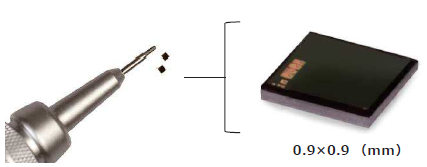
『極小タグ』は、全ての“微細なもの”を“トレース可能”にする
世界最小クラスのRFIDです。
医療分野をはじめ、小動物研究、ブランドプロテクト・在庫管理などで
利用されており、高温高圧(121度、2気圧等)に耐えうる耐熱性を
有しています。
「トライアルキット」もご用意しておりますので、ご用命の際はお気軽に
お問い合わせください。
【仕様】
■サイズ:900×900μm
■周波数:UHF帯
■通信距離:最大2mm(環境により異なる)
■メモリサイズ:TID 176 bit
(FeRAM) EPC 160 bit
※詳しくはPDF資料をご覧いただくか、お気軽にお問い合わせ下さい。
極小タグ
当社のマーキングシステムで「手術器具への刻印」した事例をご紹介します。
手術器具のトレーサビリティーを目的として、幅2.3mmの
「データマトリックスコード」を刻印。
これにより、殺菌管理を強化するだけでなく手術室内の火災探知機の
復旧作業が容易になりました。
このシステムは、「SCHAERER MAYFIELD」からインストールする
滅菌ソフトウェアと接続が可能であり、当機には、ペダルもしくは
ボタンによる電子締具が搭載されています。
【刻印情報】
■ワーク材質:ステンレス鋼
■刻印方法:データマトリックス
※詳しくは関連リンクページをご覧いただくか、お気軽にお問い合わせ下さい。
【マーキングシステム導入事例】医学 データマトリックスを刻印
医療機器洗浄センター併設のレーザーマーキング専用スペースで金属・樹脂・セラミック等へ印字を行います。
ピンポイントでレーザー照射を行うため高精度な印字が可能となります。
QRコードのような小さな文字でも印字・判別ができ、ラベルのように剥がれるリスクがない点が特徴です。
医療機器メーカー様の確実な品質管理をサポートいたします。
レーザーマーキング
当社は迅速な導入からスピーディーなプロトタイピング、
"オープン"というArasの哲学に至るまで、古いパラダイムを完全に変え、
"本当に使える"PLMを提供しています。
ここでは富士フイルム様の導入事例をご紹介します。
【導入前】
■Lotus Notes上で医療機器品質システムを稼働していたが、企業全体で最新の情報管理システムへと置き換えることを決定
■基盤システムとしてGoogleを採用したが、同社の医療機器QMSにおいては機能が十分でない事が判明
【導入後】
■導入機関の短縮・既存のQMSシステムにより容易に監査対応できるトーサビリティが実現
■既存のQMSを発展させるカスタマイズの適性
■低リスクで長期間利用できるシステムライフサイクルコスト
■IT化された新QMSを短期間で構築
そして富士フイルム様のQMS プロジェクトチームとユーザーは活用経験に基づき、Arasのアプリケーションを国内外の関係会社に展開する事を見据えています。
※詳しくはお問い合わせ、もしくはPDF資料をダウンロードしてご覧ください。
【Aras Innovator 導入事例】富士フイルム様

お探しの製品は見つかりませんでした。
1 / 1
品質管理・検査におけるトレーサビリティの監査
品質管理・検査におけるトレーサビリティの監査とは?
医療機器の開発・製造における品質管理・検査のトレーサビリティ監査とは、製品のライフサイクル全体にわたる品質情報(設計、製造、検査、出荷、保守など)が、いつ、誰が、何を、どのように行ったのかを追跡・証明できる状態になっているかを検証するプロセスです。これにより、製品の安全性と有効性を保証し、規制要件への適合性を確認します。
課題
記録の不整合と散逸
紙媒体や複数のシステムに分散した記録は、整合性を保つのが難しく、必要な情報へのアクセスに時間がかかり、監査時に不備が見つかりやすい。
手作業による記録・確認の負担
検査結果や工程記録を手作業で入力・確認する作業は、人的ミスを誘発しやすく、担当者の負担増大と非効率化を招く。
変更管理の追跡困難性
設計変更や製造工程の変更履歴が正確に記録・管理されていないと、どの変更がどの製品に影響したかを追跡できず、リスク評価が不十分になる。
規制要件への対応遅延
最新の規制要件への理解不足や、それに対応するための記録・管理体制の構築が遅れると、監査での指摘や製品承認の遅延につながる。
対策
統合型記録管理システムの導入
設計から製造、検査、出荷まで、全ての品質関連記録を一元管理できるシステムを導入し、データの整合性とアクセス性を向上させる。
自動化されたデータ収集・記録
検査機器や製造装置からのデータを自動で収集・記録する仕組みを導入し、人的ミスを削減し、記録の正確性と効率を高める。
電子的な変更管理プロセスの確立
変更要求、承認、実施、確認までの一連のプロセスを電子化し、変更履歴を明確に記録・追跡可能にする。
継続的な規制動向の把握と教育
最新の規制動向を常に把握し、関連部署への教育・研修を継続的に実施することで、コンプライアンスを維持する。
対策に役立つ製品例
統合品質管理システム
設計、製造、検査、文書管理など、品質管理に関わる全てのプロセスを統合し、トレーサビリティを確保するための包括的な機能を提供する。
電子記録・電子署名システム
紙媒体の記録を電子化し、改ざん防止機能やアクセス権限管理を備えた電子記録・電子署名機能により、信頼性の高い記録管理を実現する。
製造実行システム(MES)
製造工程におけるリアルタイムの進捗管理、作業指示、実績収集を自動化し、各工程のトレーサビリティを強化する。
文書管理・ワークフローシステム
品質マニュアル、SOP、検査手順書などの文書を一元管理し、承認ワークフローを電子化することで、変更管理と文書の最新性を保証する。